Гистология (hystos - ткань, logos - учение) - наука, трактующая о возникновении и развитии тончайшей структурной организации клеток, тканей и органов человека и животного, о ее функционировании ес о возможностях направленного воздействия на нее в интересах практики. Она изучает строение протоплазмы, обмен веществ, функциональное значение структур клеток тканей и органов, что определяет органическую связь гистологии с анатомией, биохимией, физиологией, патологической анатомией и патологической физиологией, а следовательно, и с клиническими дисциплинами.
В гистологических исследованиях широко используются биохимические и молекулярно-биологические методы при сохранении целостности клеток, позволяющие изучить структурно-биохимическую организацию их компонентов.
Методы гистологического исследования. Современные методы гистологических исследований весьма многочисленны и разнообразны. Они позволяют производить структурный и гистохимический анализ гистологических объектов на микроскопическом и субмикроскопическом уровнях.
Основным этапом микроскопического изучения животных тканей является исследование объекта средствами классического микроскопического метода, сущность которого определяется фиксацией материала исследования с последующим приготовлением окрашенных срезов. Фиксация сводится к закреплению прижизненного строения исследуемого объекта. К фиксирующим средствам относят формалин (5 - 20%), этиловый спирт, осмиевую кислоту и различные по составу смеси. После фиксации материала можно готовить тонкие срезы (1 - 10 мкм), предварительно заключив его в парафин или целлоидин. Для приготовления более толстых срезов (20 - 50 мкм) материал замораживают. Объектом исследования служат также мазки, отпечатки или тонкие пленки тканей.
Для лучшего выявления отдельных структур срезы окрашивают. Гистологические красители подразделяют на три группы: кислые, основные и специальные. Кислые красители - красящие кислоты или их соли (например, пикриновая кислота, эозин, флоксин, азокармин и др.). Кислые свойства им придают нитро-группы (NO2), хиноидные группы (0 = N = O), гидроксильные группы (ОН), карбоксильные группы (COOH). Структуры, окрашенные кислыми красителями, называют оксифильными или ацидофильными.
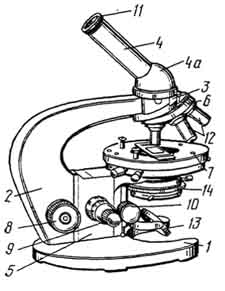
Рис. 1. Общий вид светового биологического микроскопа MБИ - 1:
1 - основание штатива; 2 - колонка штатива; 3 - головка тубусодержателя; 4 - наклонный тубус; 4а - расширенная часть наклонного тубуса; 5 - коробка микромеханизма; 6 - револьверная система; 7 - столик микроскопа; 8 - макрометрический винт; 9 - микрометрический винт; 10 - винт конденсора; 11 - окуляр; 12 - объективы; 13 - зеркало; 14 - конденсор с ирисовой диафрагмой.
У основных красителей (сафронин, пиронин, тионин и др.) окрашивающая способность определяется щелочной группой. Элементы ткани, окрашивающиеся основными красителями, определяют как базофильные. В качестве щелочных групп в основных красителях могут быть аминогруппы (NР2), монометиламиногрулпы (NH - CH3), имидогруппы (NH) и др.
Специальные красители специфически взаимодействуют лишь с определенными веществами. Например, судан III и осмиевая кислота выявляют жиры и жироподобные вещества.
Окрашенные срезы обезвоживают, заключают в канадский бальзам, покрывают покровным тонким стеклом и исследуют под микроскопом.
Световая микроскопия - основной метод анализа строения животных и растительных клеток и тканей. Современные микроскопы обеспечивают разрешение (возможность наблюдать две точки раздельно) порядка 0,2 мкм и дают максимальное увеличение в 2000 - 2500 раз (рис. 1). К световой микроскопии относят также фазово-контрастную микроскопию, флуоресцентную и ультрафиолетовую.
Фазово-контрастная микроскопия используется для исследования прозрачных бесцветных объектов, в частности живых клеток и тканей. При прохождении через такую среду фаза световых волн смещается на величину, определяемую толщиной материала и скоростью проходящего через него света. Фазово-контрастный микроскоп преобразует эти невидимые глазом фазовые сдвиги в изменении амплитуды световых волн. При этом получается черно-белое изображение, плотность отдельных участков которого зависит от величины произведения толщины объекта на разность в показателях преломления света в нем и в окружающей среде.
Флуоресцентная микроскопия. Флуоресценция - свечение объекта, возбуждаемое лучистой энергией. При данном исследовании препарат просматривают в ультрафиолетовых или фиолетовых и синих лучах. Различают собственную и наведенную
флуоресценцию, вызванную особыми красителями - флуорохромами. Последние, взаимодействуя с различными компонентами клетки, дают специфическое свечение соответствующих структур. Например, флуорохром акридиновой оранжевой с ДНК дает зеленое свечение, а с РНК - красное. Основное преимущество этого метода - возможность прижизненных наблюдений и его высокая чувствительность.
Ультрафиолетовая микроскопия основана на использовании коротких ультрафиолетовых лучей с длиной волны 0,2 мкм. Наименьшее разрешаемое расстояние ультрафиолетового микроскопа 0,1 мкм. Изображение регистрируется на фотопластинке или на люминесцентном экране.
Электронная микроскопия - метод субмикроскопического исследования, осуществляемый с помощью трансмиссионного (просвечивающего) электронного микроскопа. В таком микроскопе длина электромагнитных волн в 100 000 раз короче волны видимого света. Теоретически разрешающая способность у него составляет 5 - 10 А (0,0005 - 0,0010 мкм) при напряжении 50000 В. В современных трансмиссионных электронных микроскопах разрешающая способность составляет 0,1 - 0,7 нм. Метод сканирующей электронной микроскопии обеспечивает объемное изучение поверхностей объектов исследования.
Авторадиография. Метод цитологического исследования, позволяющий анализировать локализацию в клетках и тканях веществ, меченных радиоактивными изотопами. Включенные в клетки изотопы восстанавливают бромистое серебро фотоэмульсии, покрывающей срез. После проявления фотоэмульсии видны зерна серебра (треки), свидетельствующие о локализации в клетке меченых веществ. Методом авторадиографии выявляют место синтеза определенных веществ, пути их внутриклеточного транспорта, состав белков и др.
Гистохимические методы исследования позволяют определить химическую природу составных элементов клеток и межклеточного вещества тканей животных организмов. В основе этих методов лежит использование специфических химических реакций с образованием нерастворимых продуктов синтеза, локализованных в области изучаемых структур. Гистохимическими методами определяют в структурах тканей аминокислоты, белки, нуклеиновые кислоты (ДНК и РНК), различные виды углеводов, липидов, активность ферментов. Продукты реакции анализируют количественно.
В гистохимических исследованиях для количественного анализа применяют различные методы морфометрии, цитоспектрофотометрии, цитоспектрофлуорометрии, интерферрометрии с последующей математической обработкой цифрового материала.
Методы прижизненного исследования животных тканей. Культура тканей.
Живые клетки и ткани выращивают вне организма в специальных капсулах - в соответствующей питательной среде и при соответствующей температуре. В тканевых культурах можно изучать движение, рост, деление клеток и влияние на них различных химических и физических факторов. Данный метод широко используют при изучении вирусов. В культурах тканей изучают строение и жизнедеятельность клеток, используя цейтраферную микрокиносъемку, фотографируя клетки культуры с определенными, оптимальными для анализа интервалами времени па кинопленку.
Культивирование тканей можно проводить в организме животного, помещая их в камеры с пористой стенкой ("диффузионные камеры").
Прижизненная окраска тканей. Некоторые коллоидные красители (метиленовый синий, нейтральный красный, трипановый синий и др.) в определенных дозах нетоксичны и при введении их в кровь животному окрашивают соответствующие структуры тканей.